ホーム > トピック・関連情報 > プレスリリース > 腸内細菌による食後血糖調節機構の解明
腸内細菌による食後血糖調節機構の解明
~マクロファージの食後反応と肥満による破綻から見る新規治療への希望~
2020年5月28日
発表者:
戸田 郷太郎(東京大学医学部附属病院 糖尿病・代謝内科 病院診療医)
山内 敏正(東京大学医学部附属病院 糖尿病・代謝内科 教授)
門脇 孝(研究当時:東京大学医学部附属病院 22世紀医療センター 糖尿病・生活習慣病予防講座 特任教授/現:国家公務員共済組合連合会 虎ノ門病院 院長)
植木 浩二郎(国立国際医療研究センター研究所 糖尿病研究センター長)
発表のポイント:
- 正常な状態では、免疫担当細胞が食後に腸内細菌由来のLipopolysaccharide (LPS)とインスリンに反応し、インターロイキン10 (IL-10)を産生することにより食後高血糖を防いでいることが分かりました。
- この研究では、食事によって腸内細菌が大きく変化し、その刺激で免疫担当細胞が糖新生を 抑制する物質を産生して、正常な食後血糖を維持していることを世界に先駆けて明らかにしました。
- 肥満や糖尿病状態での免疫担当細胞の機能不全を改善する方法や、腸内細菌の正常化が肥満・糖尿病の新たな治療法になりうると考えられます。
発表概要:
肥満 ※1は種々の合併症を引き起こす2型糖尿病※2の要因のひとつであり、肥満が引き起こす脂肪組織での慢性炎症は糖尿病の重要な病態であるインスリン抵抗性※3を促進すると考えられています。炎症は免疫反応の一つですが、最近では短期的な免疫反応が生体の恒常性維持に関与している可能性も示唆されています。
今回、東京大学医学部附属病院 糖尿病・代謝内科の戸田郷太郎 病院診療医、山内敏正 教授、糖尿病・生活習慣病予防講座 門脇孝 特任教授(研究当時、現 虎ノ門病院 院長)、国立国際医療研究センター研究所の植木浩二郎 糖尿病研究センター長の研究グループは、組織特異的ノックアウトマウス※4を用いた検討を行い、摂食後の小腸内Lipopolysaccharide (LPS)産生菌の一過性の増加およびインスリン分泌に反応したマクロファージがAkt-mTOR経路の活性化によりインターロイキン10(IL-10)を産生し、IL-10がインスリンと共に肝臓での糖新生遺伝子発現※5を抑制することを発見しました(図1)。肥満したマウスではマクロファージでのインスリンシグナルおよびIL-10産生が減弱しており、アデノウイルスを用いてIL-10を発現させると食後高血糖、高インスリン血症が改善することから、免疫反応の食事摂取に対する生理的な応答を回復もしくは維持することが肥満・糖尿病の治療目標になりうると考えられます。
本研究成果は日本時間2020年5月28日午前0時(米国東部夏時間 2020年5月27日午前11時)にMolecular Cell(オンライン版)にて発表されます。
発表内容:
肥満状態では、免疫反応の活性化により慢性炎症を起こすことでインスリン抵抗性を増強することが多くの報告により明らかになっています。また、細菌の菌体成分であるLPSは肥満したマウスで慢性的に増加しており、免疫担当細胞で炎症と関連する遺伝子を含む多数の遺伝子発現を増強することから肥満を増悪させる因子と考えられてきました。一方で、種々の外的刺激に対する一過性の免疫反応が生体の恒常性維持において重要であるとも考えられるようになってきています。実際に、健康なヒトやマウスでは食事を摂取することによって一過性にLPSの血中濃度が上昇することが知られています。本研究は、摂食後におけるLPSの一過性の血中濃度増加=免疫反応の活性化が、正常な状態で果たす役割を明らかにすることを目的として行われました。
通常食を摂取した非肥満マウスでは、LPSを産生する腸内細菌が小腸内で一過性に増加していました。一方、門脈内では、LPSに反応して免疫担当細胞が産生する因子のうち、炎症をむしろ抑制すると考えられているIL-10の濃度が上昇していました。培養した肝細胞において食後に門脈内で認められる生理的濃度のインスリン単独では肝糖新生遺伝子が抑制されないが、IL-10との共刺激、またインスリンとLPSで刺激した骨髄由来マクロファージの培養上清の添加では抑制されました。その一方で、IL-10ノックアウトマウス由来のマクロファージの培養上清ではこのような糖新生遺伝子発現の抑制は見られず、培養した肝細胞の糖新生遺伝子抑制がIL-10とインスリンに依存すると考えられました。また、マウスにIL-10受容体の一部であるIL-10rbに対するshRNAをコードしたアデノウイルスを感染させ、肝臓でのIL-10rbの遺伝子発現を抑制すると、摂食による糖新生遺伝子発現の抑制が障害されたことから、IL-10のシグナルが肝臓での食後糖代謝調節に重要と考えられました。
さらに、免疫担当細胞でのIL-10発現機構を明らかにするために検討を進めると、IL-10はマクロファージでLPSとインスリンの共刺激により短時間で強力に誘導されました。この反応はLPSの受容体であるToll-like receptor (TLR)-4の機能が低下したC3H/HeJマウスやインスリン受容体をノックアウトしたマクロファージで低下していました。また、マクロファージでのIL-10発現はインスリン受容体下流でPI3キナーゼ(PI3K)の阻害薬により低下したことから、PI3K-Akt経路の代謝調節での役割を検討するため、骨髄系細胞特異的Akt1/Akt2欠損マウスを用いました。このマウスのマクロファージではインスリン、LPSによるIL-10発現は減弱し、食後の糖新生遺伝子発現抑制が障害されました。Aktにより抑制されmammalian target of rapamycin (mTOR)を抑制するtuberous sclerosis complex (TSC)2がAkt1/Akt2と同時に骨髄系細胞特異的に欠損したマウスではマクロファージのmTORが活性化され、コントロールと同等の摂食反応が見られたことから、マクロファージのAkt-mTORシグナルが食後血糖調節に重要と考えられました。
高脂肪食を摂取し肥満したマウスでは内臓脂肪組織マクロファージのインスリン刺激によるAktリン酸化、またIL-10陽性率が低下しており、食後の糖新生遺伝子発現は抑制されませんでしたが、アデノウイルスを用いてIL-10を強制発現すると食後血糖は低下し、肝糖新生遺伝子発現は抑制されました。免疫担当細胞由来のIL-10作用を検討するためにIL-10ノックアウトマウスから野生型マウスへの骨髄移植実験を行いました。このマウスは、体重が減少して全身のインスリン感受性が亢進しているにもかかわらず、ピルビン酸負荷試験での食後の糖新生は同等であり食後の免疫担当細胞由来のIL-10が糖新生を抑制することを支持する結果となりました。これらの結果から、マクロファージが食後腸管由来のLPSとインスリンに反応しAkt-mTOR依存的にIL-10を発現し、インスリンと協働して肝糖新生を抑制する経路が生理的な状態での食後糖代謝調節に重要と考えられました(図1)。
本研究で得られた成果から、免疫担当細胞の体外因子に対する反応性を維持することが肥満・糖尿病の新たな治療目標になりうることが分かり、今後新たなバイオマーカー・治療手法の開発につながることが期待されます。
発表雑誌:
- 雑誌名:Molecular Cell(オンライン版:米国東部夏時間2020年5月27日)
- 論文タイトル:Insulin and lipopolysaccharide mediated signaling in adipose tissue macrophages regulates postprandial glycemia through Akt-mTOR activation.
- 著者:Gotaro Toda, Kotaro Soeda, Yukiko Okazaki, Naoki Kobayashi, Yukari Masuda, Naoko Arakawa, Hirotsugu Suwanai, Yosuke Masamoto, Yoshihiko Izumida, Nozomu Kamei, Takayoshi Sasako, Ryo Suzuki, Tetsuya Kubota, Naoto Kubota, Mineo Kurokawa, Kazuyuki Tobe, Tetsuo Noda, Kenya Honda, Domenico Accili, Toshimasa Yamauchi, Takashi Kadowaki*, and Kohjiro Ueki* (* 責任著者)
- DOI番号:https://doi.org/10.1016/j.molcel.2020.04.033
問い合わせ先:
研究に関するお問い合わせ先
国立国際医療研究センター研究所
糖尿病研究センター長 植木 浩二郎(うえき こうじろう)
電話:03-5273-5355
E-mail:uekik@ri.ncgm.go.jp
東京大学医学部附属病院 糖尿病・代謝内科
戸田 郷太郎(とだ ごうたろう)
電話:03-3815-5411(代表) 内線35457
E-mail: gtoda-tky@umin.ac.jp
広報担当者連絡先
東京大学医学部附属病院 パブリック・リレーションセンター
担当:渡部、小岩井
電話:03-5800-9188(直通)
E-mail:pr@adm.h.u-tokyo.ac.jp
国立国際医療研究センター 広報企画室 広報係長
担当:西澤 樹生
電話:03-5273-5258(直通) <9:00~17:00>
E-mail:press@hosp.ncgm.go.jp
用語解説:
- 肥満
運動不足、食事過多の他遺伝因子が関与し正常よりも大幅に体重が増加した状態。全身の糖脂質代謝異常のほか、心血管疾患のリスクが上昇する。 - 糖尿病
遺伝因子、運動不足食習慣などの環境因子によりインスリン作用が低下し、慢性高血糖の結果種々の合併症を生じる症候群。 - インスリン抵抗性
肥満などが関与し臓器のインスリンに対する反応が低下した状態。 - 組織特異的ノックアウトマウス
ある組織でCre recombinaseを発現することにより、ゲノム上でloxP配列に挟まれた目的遺伝子を欠失させたマウス。 - 糖新生
絶食時に増強する、アミノ酸などからブドウ糖を生成するプロセス。
添付資料:
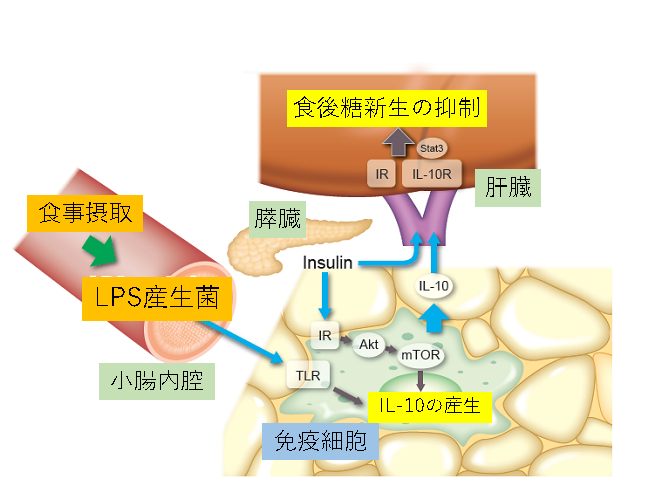
図1:正常な状態での免疫細胞の食後応答














