ホーム > トピック・関連情報 > プレスリリース > NQO1はIκB-ζを分解することにより、Toll様受容体によるIL-6などのサイトカイン産生を選択的に抑制する
NQO1はIκB-ζを分解することにより、Toll様受容体によるIL-6などのサイトカイン産生を選択的に抑制する
2018年6月27日
国立国際医療研究センター
米国科学誌『Journal of Experimental Medicine』掲載
NQO1 inhibits the TLR-dependent production of selective cytokines by promoting IκB-ζ degradation.
(要旨)
自然免疫応答は細菌やウィルス感染に対して生体内で最初に起こる免疫反応として知られています。自然免疫が過剰に活性化されると、敗血症や自己免疫疾患というような重篤な疾患の原因となります。
ところが、この自然免疫応答の制御機構に関しては不明な点も多く残されています。 国立国際医療研究センター(NCGM)肝炎・免疫研究センター免疫病理研究部 鈴木 春巳 部長および同部細胞免疫研究室 木村 彰広 室長らの研究グループは抗酸化酵素の一つとして知られているNAD(P)H:quinone oxidoreductase 1 (NQO1)が細菌の構成成分であるLipopolysaccharide (LPS)により誘導されることを見出し、LPS誘導性IL-6などの特定のサイトカイン産生を抑制していることを明らかにしました。細菌感染などによる敗血症の誘導にはIL-6が非常に重要な役割を果たしていることが報告されていることから、今回の発見は敗血症に対してNQO1を標的とした新規治療法の確立が期待されます。
研究の背景
敗血症は細菌やウィルスなどの感染症により、全身に炎症が拡がり、進行すると多臓器不全や敗血症ショックといった重篤な病態に陥ることになります。現在、世界で年間2,000万人以上もの人が新たに発症しており、その中のかなりの割合の人が敗血症で亡くなっているとされています。
この敗血症を誘発する最初のきっかけとなるのが、細菌の構成成分を認識し自然免疫応答を活性化させるToll-like receptor (TLR)と呼ばれる受容体からのシグナル伝達とされています。このTLRからのシグナルが適切に細胞内に伝わると自然免疫応答が活性化され、細菌やウィルスが排除されていきます。ところが、TLRシグナルが過剰に伝達されると、IL-6などのサイトカインが多量に産生され敗血症ショックになります。そのため、TLRシグナルからのIL-6産生制御機構の解明は、敗血症ショックの発症機序の解明やその治療法の確立において非常に重要であるといえます。
本研究の概要
研究グループは、マクロファージにおいてLPS刺激後、NQO1の発現が誘導されることを発見しました。次にLPSにより誘導されるサイトカイン産生にNQO1が関与しているかを調べました。野生型 (wild type; WT)とNQO1欠損マクロファージをLPSで刺激した後、IL-6やTNF-αなどのサイトカイン量を比較したところIL-6やIL-12などのサイトカインのみがNQO1欠損マクロファージで著しく高くなっていました。一方で、TNF-αやIL-10産生は両者において差は認められませんでした。このことから、NQO1は自然免疫応答により誘導されるIL-6などの一部のサイトカインのみを抑制していることが判明しました。またNQO1欠損マウスではWTマウスに比べてLPSに対する感受性が非常に高くなっており、生体内においてもNQO1が自然免疫応答を抑制し、敗血症から体を守っていることが示されました。
LPSシグナルによるIL-6やIL-12の産生にはIκB-ζという転写因子が関与しています。IκB-ζ はLPSなどの刺激により誘導される核内転写因子で、誘導後分解されることが知られています。研究グループはIκB-ζがユビキチン依存的に分解され、さらにNQO1がその分解に関与していることを発見しました。ところが、NQO1自体にユビキチン分解酵素としての機能はないことから、IκB-ζをユビキチン化している酵素を探索したところ、PDLIM2と呼ばれる核内ユビキチン化酵素が同定されました。NQO1がPDLIM2によるIκB-ζ のユビキチン化にどのように関与しているのかを調べた結果、NQO1はPDLIM2とIκB-ζが結合する際に、橋渡しタンパクとして作用していることが分かりました。
これらの結果から、NQO1はユビキチン化酵素であるPDLIM2と複合体を形成し、IκB-ζをユビキチン依存的に分解することで、IL-6などの特定のサイトカインの産生を抑制していることが明らかになりました。つまり、自然免疫応答の制御においてNQO1は、これまで知られていた抗酸化酵素としての機能ではなく、橋渡しタンパクとしての新たな機能を有していることが明らかとなり、NQO1-PDLIM2複合体を中心とした新たな自然免疫応答の制御機構が解明されました(下図参照)。
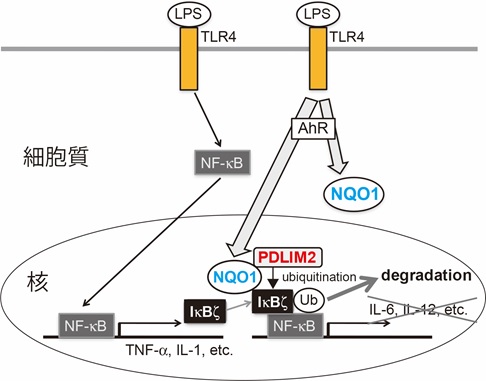
(図)LPS刺激により、IL-6やTNF-αなどさまざまなサイトカインが誘導されます。TNF-α やIL-1産生はNF-κBにより直接誘導されますが、IL-6やIL-12産生は、NF-κB により誘導されるIkB-zが必要となります。NQO1はLPSにより誘導され核内へと移行します。その後、核内ユビキチン化酵素PDLIM2と結合し、PDLIM2とIκB-ζとの結合を促進することで、IκB-ζがユビキチン依存的に分解されます。結果、LPSの下流で誘導されるIL-6やIL-12を選択的に抑制することになります。
本研究の意義・今後の展望
これまでに、敗血症の治療としてTNF-αやIL-1に対する中和抗体が試されてきましたが、これらの治療法は動物モデルでは効果がありましたが、ヒトに対しては効果を示しませんでした。一方で、IL-6は敗血症による死亡率と高い関連性があり、敗血症においてIL-6産生を制御することは重要であると考えられています。今回、研究グループは自然免疫応答においてNQO1がIL-6産生を選択的に抑制するメカニズムを明らかにしました。また、その作用機序として、これまで知られていた抗酸化酵素としてのNQO1の機能ではなく、橋渡しタンパクとしてのNQO1の新たな機能を発見しました。
今後は、この橋渡しタンパクを促進する様なNQO1リガンドを同定することで、敗血症においてIL-6を選択的に強く抑制できる新規な治療薬の開発が期待されます。
発表雑誌
雑誌名:Journal of Experimental Medicine
論文名:NQO1 inhibits the TLR-dependent production of selective cytokines by
promoting IκB-ζ.
本件に関するお問合せ先
国立国際医療研究センター研究所 肝炎・免疫研究センター 免疫病理研究部
責任著者役職名 免疫病理研究部長 鈴木 春巳(すずき はるみ)
電話:047-373-5539(内線 1463) FAX:047-372-3501
E-mail: lbhsuzuki@hospk.ncgm.go.jp
〒272-8516 千葉県市川市国府台1-7-1
取材に関するお問合せ先
国立国際医療研究センター 企画戦略局 広報企画室
広報係長:西澤 樹生(にしざわ たつき)
電話:03-3202-7181(代表) <9:00~17:00>
E-mail:press@hosp.ncgm.go.jp















