ホーム > トピック・関連情報 > プレスリリース > 絶食で経口ワクチンの効果が消失する仕組みを発見
絶食で経口ワクチンの効果が消失する仕組みを発見
-腸管免疫の機能維持には食事が必須-
2019年8月22日
慶應義塾大学薬学部
国立国際医療研究センター
慶應義塾大学薬学部は国立国際医療研究センター(略称:NCGM)との共同研究により、腸管の健康維持に重要な抗原特異的な免疫応答が、絶食によって消失する仕組みを発見しました。これは慶應義塾大学薬学部の永井基慈(博士課程学生)、長谷耕二教授、土肥多惠子客員教授、NCGM肝炎・免疫研究センター 消化器病態生理研究室の河村由紀室長を中心とする研究グループの成果です。
世界には、必要最低限の栄養の確保が困難な絶対的貧困に位置する人が約7億人おり、国際的な問題となっています。さらに、紛争や飢饉によって低栄養状態にある子供は感染症にかかりやすく、ワクチンにより得られる効果が低いことも報告されています。ワクチンの効果には免疫系における記憶(免疫記憶)が定着するかどうかが鍵を握ります。これまで、栄養が免疫系の機能に影響を与えることは知られていましたが、栄養が遮断された絶食状態における免疫系の変化についてはほとんど解明されていませんでした。今回研究グループは、一時的に絶食を施した際に、腸管のパイエル板において免疫記憶の形成に重要な胚中心B細胞が細胞死を起こすことを発見しました。一方で、活性化前のナイーブB細胞は絶食時に骨髄へと一時的に退避し、再摂食後には速やかにパイエル板に帰還することを明らかにしました。そのため、経口ワクチン投与後に絶食-再摂食を行うと、活性化した胚中心B細胞のみが消失し、経口ワクチンの効果が著しく減少することが分かりました。
本研究は、飢餓に対して免疫系が適応する仕組みの一端を明らかにしたとともに、栄養シグナルによって免疫応答の制御が可能であることを示唆するものです。今後の研究の発展により、食事介入による効果的なワクチン接種方法の開発へつながることが期待されます。本研究成果は、2019年8月23日(米国東部時間)に国際学術誌『Cell』に掲載されます。
本研究のポイント
- 絶食により、パイエル板の胚中心B細胞(活性化B細胞)は失われる。
- パイエル板のナイーブB細胞は、絶食時に骨髄へと一時的に退避し、再摂食によって回復する。
- ワクチンの開発において栄養介入という新たな研究アプローチが示された。
研究の背景
人類の歴史は飢餓との戦いの歴史であり、ヒトには本来絶食状態に適応した生命維持機構が備わっていると考えられます。しかしながら、貧困などによる極端な低栄養状態においては、感染症の拡大やワクチンによって得られる効果の低下が引き起こされることが知られています。一方で、現在、多くの地域では食料はいつでも入手可能となり、不規則な生活習慣も伴い絶食をする機会はほぼ失われています。近年の研究から、絶食を“しないこと”が代謝だけでなく免疫系の異常も引き起こすことが指摘されており、短期間の絶食によってこれらの異常を改善することが報告されています。このように、栄養シグナルによって免疫系が制御されていることが示唆されていますが、絶食とそれに続く再摂食が免疫系にもたらす影響はほとんど未解明でした。
研究の内容・成果
本研究では初めに、絶食-再摂食期間に腸管の免疫を担う細胞がどのように振る舞うかに着目をして研究を行いました。免疫系の記憶形成に重要な組織として小腸のパイエル板が知られています。口から入った抗原はパイエル板において取り込まれ、ナイーブB細胞に提示されます。抗原の提示を受けたナイーブB細胞が胚中心B細胞を経て抗原に特異的なIgA陽性のB細胞へと成熟することで抗原特異的な抗体産生細胞が形成されます。私たちは、絶食によってパイエル板の全てのB細胞集団が顕著に減少することを見出しました。興味深いことに、再摂食時にはナイーブB細胞だけが急速に細胞数を回復させることも発見しました(図1)。
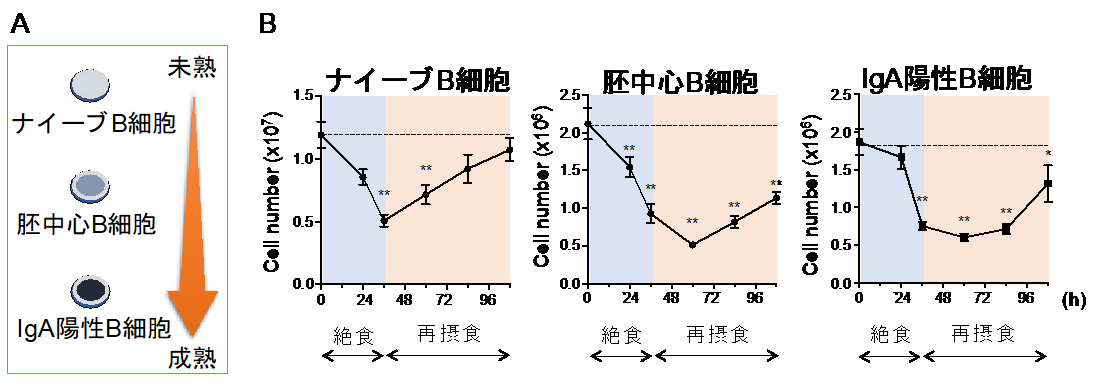
図1 絶食-再摂食によってパイエル板のリンパ球は入れ替わる
(A)パイエル板においてナイーブB細胞は胚中心B細胞を経てIgA陽性B細胞へと成熟する。
(B)絶食(青背景)によって全てのB細胞が減少するが、再摂食時(オレンジ背景)に回復するのはナイーブB細胞だけであった。この結果、再摂食後のパイエル板では胚中心B細胞やIgA陽性B細胞がナイーブB 細胞へと置き換わる。
パイエル板において死細胞の観察を行ったところ、絶食時に顕著に細胞死が起きていることを見出しました。さらに、細胞死は再摂食時に回復の遅かった胚中心B細胞が多く集まる領域に集中して観察されました(図2)。免疫担当細胞のうち、胚中心B細胞のような活性化細胞はエネルギー要求性の高いことが知られています。絶食時には利用可能な栄養が限られており、脳や心臓といった生きるために不可欠な組織への栄養を確保するために粘膜免疫系の細胞を減らすことでエネルギーを節約していると考えられます。
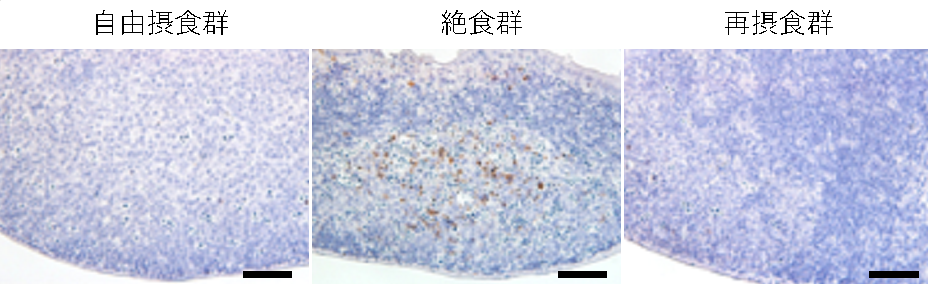
図2 絶食時のパイエル板では細胞死が起きている
自由摂食時、絶食時、再摂食時のマウスのパイエル板を死細胞(アポトーシス)マーカーであるCleaved Caspase-3(茶色)を用いて染色した。対比染色としてヘマトキシリン(青紫)で染色を行った。ヘマトキシリンの色が薄い部分が胚中心B細胞の多い領域で、絶食時に死細胞も多いことが確認できた。
続いて、ナイーブB細胞のふるまいに着目しました。再摂食時に急速にパイエル板での細胞数を回復させたことから、一時的に他の組織に移動していると考えて研究を進めました。この結果、絶食時にナイーブB細胞は、ナイーブB細胞の遊走に重要なケモカインであるCXCL13の遺伝子発現変化に応じて骨髄へと移動していることを発見しました。この現象は、絶食時にナイーブB細胞の一部を骨髄に一時的にリザーブしておくことで、再摂食によって栄養が利用できるようになった際に、迅速に免疫応答を担うようにしていると考えられます(図3)。
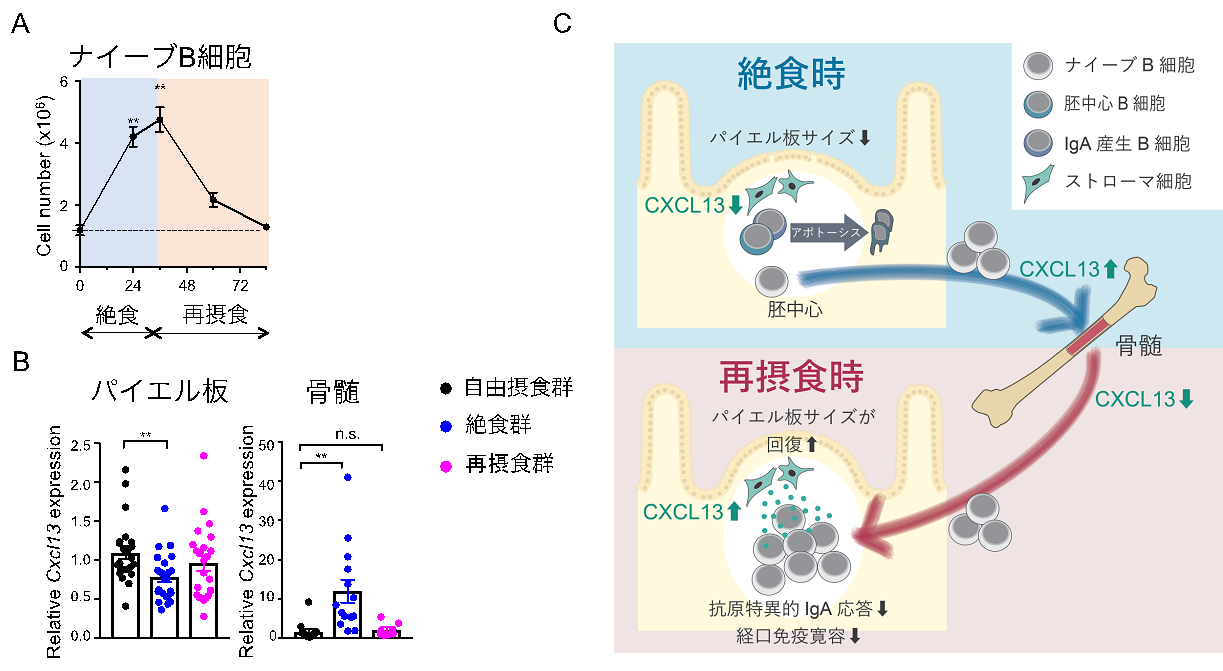
図3 絶食-再摂食時のナイーブB細胞のふるまい
(A)骨髄における絶食-再摂食時のナイーブB細胞のふるまいはパイエル板と真逆である。
(B)ナイーブB細胞の遊走に重要なケモカインであるCXCL13の遺伝子発現が、絶食時にパイエル板では低下し て、骨髄では逆に上昇している。
(C)パイエル板のナイーブB細胞は、CXCL13の発現変化に応じて絶食時に一時的に骨髄へ退避することで再摂 食後の免疫応答を担っている。
最後に絶食が粘膜における獲得免疫(抗原特異的免疫)に与える影響を解析しました。卵白抗原(卵白アルブミン)とアジュバントによる経口ワクチンを投与することで、卵白抗原に対して特異的なIgA抗体を誘導することができます。そこで、この誘導期間中に絶食を繰り返し、絶食がワクチン効果に与える影響を調べました(図4A)。この結果、絶食を繰り返すことで卵白抗原特異的なIgAの産生が抑えられることから、絶食は経口ワクチンの効果を減弱させることがわかりました(図4B)。絶食時にはパイエル板において、卵白抗原特異的な胚中心B細胞が失われることが原因だと考えられます。
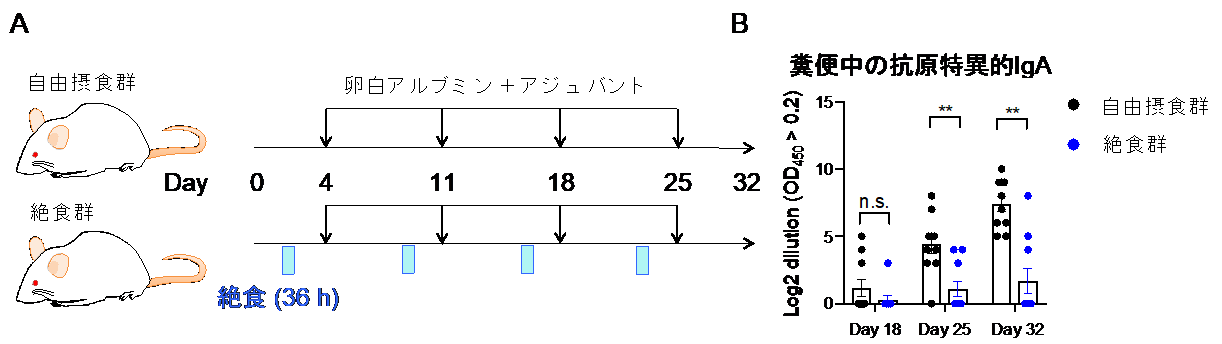
図4 絶食-再摂食の繰り返しは免疫記憶を消失させる
(A)経口投与で卵白抗原とアジュバンドを与えることで免疫記憶を誘導した。一方の群には1週間に1回36時間の絶食を施した。
(B)絶食を施した群においては、経口ワクチン投与によるIgAの誘導が起こりにくい。
本研究は、これまで理解の進んでいなかった免疫系が飢餓に対して適応する仕組みの一端を明らかにしたとともに、栄養によって免疫応答の制御が可能であることを示唆するものです。今後研究を発展させることで、食事介入による効果的なワクチン接種方法の開発へつながることが期待されます。
原論文情報
-
Motoyoshi Nagai, Ryotaro Noguchi, Daisuke Takahashi, Takayuki Morikawa, Kouhei Koshida, Seiga Komiyama, Narumi Ishihara, Takahiro Yamada, Yuki I. Kawamura, Kisara Muroi, Kouya Hattori, Nobuhide Kobayashi, Yumiko Fujimura, Masato Hirota, Ryohtaroh Matsumoto, Ryo Aoki, Miwa Tamura-Nakano, Machiko Sugiyama, Tomoya Katakai, Shintaro Sato, Keiyo Takubo, Taeko Dohi, and Koji Hase† (†責任著者)
Fasting-refeeding impacts immune cell dynamics and mucosal immune responses. Cell (2019)
DOI:10.1016/j.cell.2019.07.047
本発表資料のお問い合わせ先
- 慶應義塾大学薬学部 生化学講座
教授 長谷 耕二(はせ こうじ)
TEL:03-5400-2654 FAX:03-5400-2484
E-mail:hase-kj@pha.keio.ac.jp - 国立国際医療研究センター研究所
肝炎・免疫研究センター 消化器疾患研究部
消化器病態生理研究室長 河村 由紀
TEL:047-375-4754(内線:1461) FAX:047-375-4766
E-mail: kawamura@hospk.ncgm.go.jp - 本リリースの発信元
慶應義塾広報室(栗原)
TEL: 03-5427-1541 FAX: 03-5441-7640
E-mail:m-pr@adst.keio.ac.jp https://www.keio.ac.jp/
取材に関するお問合せ先
国立国際医療研究センター 企画戦略局 広報企画室
広報係長:西澤 樹生(にしざわ たつき)
電話:03-3202-7181(代表) <9:00~17:00>
E-mail:press@hosp.ncgm.go.jp















