ホーム > トピック・関連情報 > プレスリリース > B型肝炎ウイルス感染抑制する抗体を開発
B型肝炎ウイルス感染抑制する抗体を開発
―ウイルス侵入受容体をターゲットにした新しい抗体医薬に貢献―
2022年1月14日
理化学研究所
国立国際医療研究センター
広島大学
理化学研究所(理研)生命医科学研究センター創薬抗体基盤ユニットの竹森利忠基盤ユニットリーダー(研究当時、現炎症制御研究チーム客員研究員)、生命機能科学研究センター創薬タンパク質解析基盤ユニットの白水美香子基盤ユニットリーダー、科技ハブ産連本部創薬・医療技術基盤プログラムの深見竹広マネージャー、後藤俊男プログラムディレクター(研究当時)、国立国際医療研究センター(NCGM)肝炎・免疫研究センターの下遠野邦忠客員部長、広島大学大学院医系科学研究科の茶山一彰教授らの共同研究グループ※は、B型肝炎ウイルス(HBV)の感染受容体であるヒトNa+/タウロコール酸共輸送ポリペプチド(NTCP)[1]に結合し、HBV粒子のヒト肝細胞への感染を阻害するモノクローナル抗体[2]を開発しました。本研究成果は、新たなB型慢性肝炎抗体医薬[3]の開発に貢献すると期待できます。
現在、慢性肝炎を完治できる治療薬はなく、治療には主に核酸アナログ製剤[4]が使用されています。しかし、投薬法や安全性に問題があり、作用機序の異なる治療方法の構築が求められています。今回、共同研究グループが開発したモノクローナル抗体(N6HB426-20 mAb)は、HBVの変異、遺伝子型[5]、血液中のHBs抗原[6]陽性の非感染性中空粒子[7]の存在に影響されることなくHBV感染を阻害でき、かつウイルス感染阻止に必要な抗体量では、NTCPの本来の機能である肝細胞への胆汁酸[8]を取り込む輸送体としての生理活性は阻害されません。
本研究は、科学雑誌『Journal of Virology』(3月9日号)の掲載に先立ち、1月5日付でオンライン掲載されました。
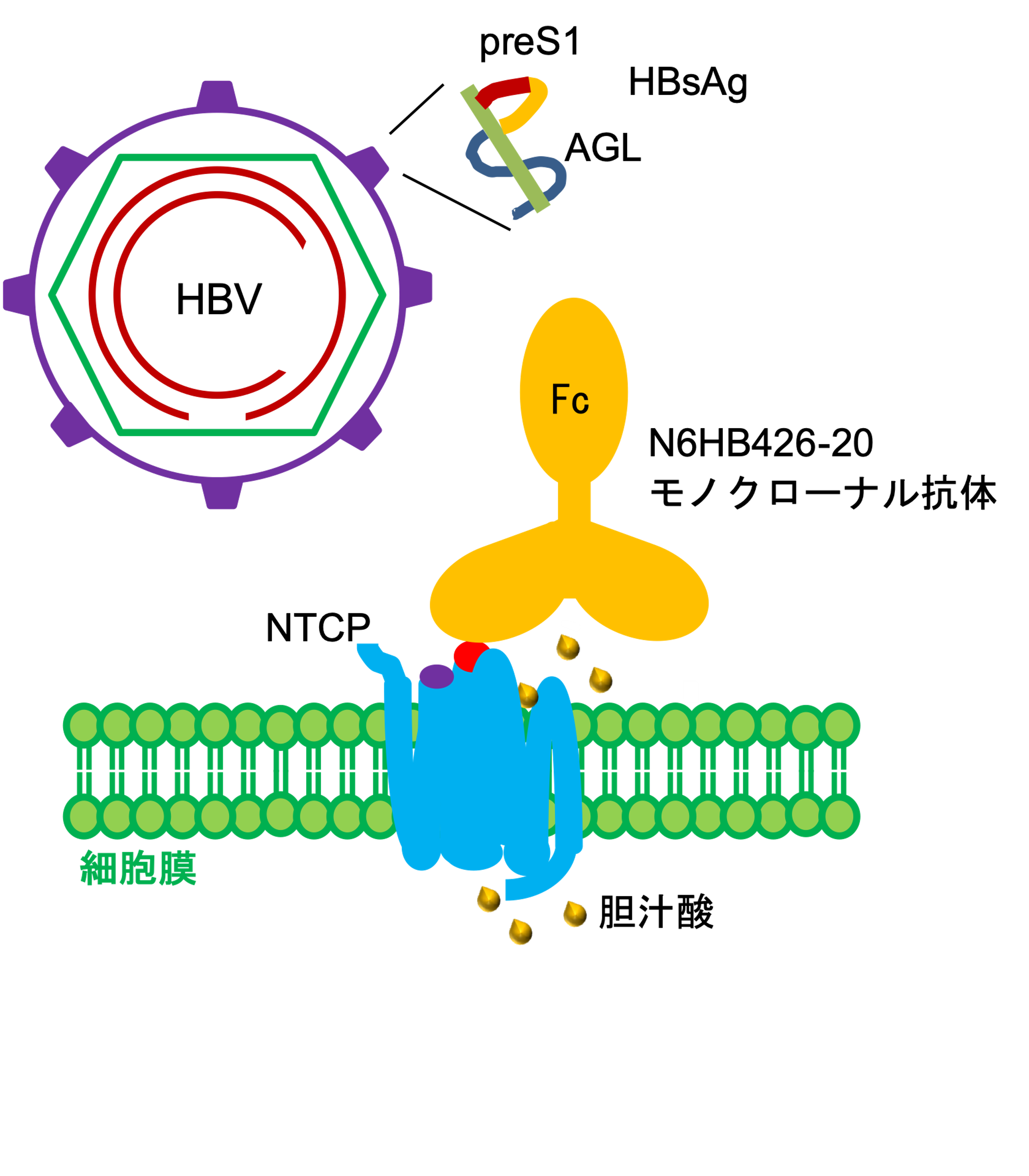
図: N6HB426-20モノクローナル抗体はB型肝炎ウイルス(HBV)のNTCPへの結合を阻害する
共同研究グループ
理化学研究所
生命医科学研究センター
■創薬抗体基盤ユニット
- 基盤ユニットリーダー(研究当時) 竹森 利忠 (たけもり としただ)
(現 理研 生命医科学研究センター 炎症制御研究チーム 客員研究員) - 研究員 原田 通成 (はらだ みちしげ)
- テクニカルスタッフ (研究当時) 杉本 晶子 (すぎもと あきこ)
(現 理研 生命医科学研究センター 炎症制御研究チーム テクニカルスタッフⅠ) - テクニカルスタッフ(研究当時) 田中 実穂 (たなか みほ)
- テクニカルスタッフ(研究当時) 谷口 真沙美(たにぐち まさみ)
■免疫シグナル研究チーム
- チームリーダー 齊藤 隆 (さいとう たかし)
(創薬抗体基盤ユニット 基盤ユニットリーダー)
■免疫器官形成研究チーム
- チームリーダー 古関 明彦 (こせき あきひこ)
- 上級研究員(研究当時) 磯野 協一 (いその きょういち)
(現 和歌山県立医科大学 動物実験施設 准教授/
理研 生命医科学研究センター 免疫器官形成研究チーム 客員研究員)
■炎症制御研究チーム
- チームリーダー 田中 貴志 (たなか たかし)
環境資源科学研究センター ケミカルバイオロジー研究グループ
- グループディレクター 長田 裕之 (おさだ ひろゆき)
- 研究員 二村 友史 (ふたむら ゆうし)
生命機能科学研究センター
■創薬タンパク質解析基盤ユニット
- 基盤ユニットリーダー 白水 美香子(しろうず みかこ)
- 上級研究員(研究当時) 染谷 友美 (そめや ともみ)
(現 国立感染症研究所 細胞化学部 主任研究官/理研 生命機能科学研究センター タンパク質機能・構造研究チーム 客員研究員) - 研究員 松本 武久 (まつもと たけひさ)
■創薬分子設計基盤ユニット
- 基盤ユニットリーダー 本間 光貴 (ほんま てるき)
科技ハブ産連本部 創薬・医療技術基盤プログラム
- プログラムディレクター(研究当時)後藤 俊男 (ごとう としお)(現 理研 業務顧問)
- マネージャー 深見 竹広 (ふかみ たけひろ)
国立国際医療研究センター(NCGM) 肝炎・免疫研究センター
- 客員部長 下遠野 邦忠(しもとおの くにただ)
- 上級研究員(研究当時) 西辻 裕紀 (にしつじ ひろのり)
(現 藤田医科大学 ウイルス・寄生虫学 講師)
広島大学 大学院医系科学研究科
- 医療イノベーション共同研究講座
教授 茶山 一彰 (ちゃやま かずあき)
(理研 生命医科学研究センター 客員主管研究員) - 消化器・代謝内科学
講師 三木 大樹 (みき だいき)
研究支援
本研究は、日本医療研究開発機構(AMED)感染症実用化研究事業(肝炎等克服実用化研究事業)「B型肝炎創薬実用化等研究事業」による支援を受けて行われました。
1.背景
B型肝炎ウイルス(HBV)はDNA型の肝炎ウイルスで、HBVの持続感染者は全世界で約3億人、日本では100万人弱と推定されています。HBV感染には、出血を伴う医療行為などによる経皮的感染と、性交渉、分娩時の経粘膜感染があります。乳幼児期の感染では免疫系が未発達のため、多くが持続感染となり沈静化しますが、 10~20%の症例でB型慢性肝炎に移行します。また、成人での初感染者の多くは一過性の感染で治癒しますが、少数は無症候性HBVキャリア(保有者)やB型慢性肝炎に移行します。B型慢性肝炎では、肝機能の悪化・再燃を繰り返し、肝硬変、肝不全、肝がんに進行する率が高く、感染の予防対策や抗ウイルス薬の開発が極めて重要です。
HBVは不完全な2本鎖DNAを持つウイルスで、そのゲノムはヌクレオカプシドに格納され、その外側をエンベロープ(外殻)が囲んでいます(図1)。HBV感染は、HBV外皮タンパク質「preS1」と肝臓に発現する受容体「ヒトNa+/タウロコール酸共輸送ポリペプチド(NTCP)」との間の高親和性相互作用により、HBVが細胞内に侵入し成立します。感染後、HBVは肝細胞核内にcccDNA(covalently closed circular DNA) [9]と呼ばれる2本鎖DNAを形成します。cccDNAからプレゲノムRNAが転写され、このRNAから逆転写によりウイルスDNAが複製されます(図1)。
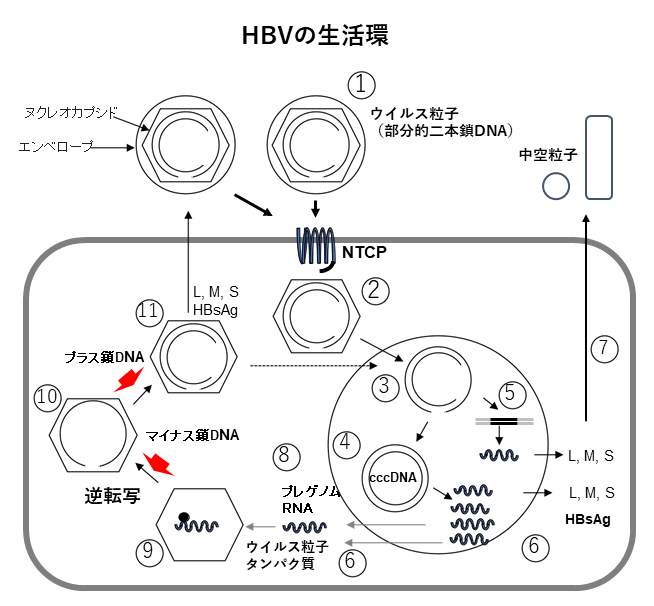
図1 B型肝炎ウイルス(HBV)の生活環
HBVは不完全2本鎖 DNA を持ち、ゲノムはヌクレオカプシドに格納され、さらに外側をエンベロープで取り囲まれている(①)。HBVが肝細胞内に侵入すると、HBVゲノムはヌクレオカプシドから放出され(②)、核へ移行する(③)。核内の不完全2本鎖 DNAはcccDNA に変換され(④)、または宿主細胞のゲノムに挿入され(⑤)、逆転写酵素、HBコア関連抗原、HBs抗原(L、M、S)をコードするmRNAを転写、翻訳される(⑥)。HBVの複製に関してcccDNA の遺伝情報はプレゲノムRNAに変換され(⑧)、逆転写酵素とともにカプシドに取り込まれる(⑨)。プレゲノムRNAから1本鎖DNA(マイナス鎖)が合成され(⑩)、続いてマイナス鎖に相補的なプラス鎖 が合成される(⑪)。その後、感染性ウイルスとして細胞外へ放出される。HBV cccDNA から転写される mRNAの一部から翻訳されたL、M、Sタンパク質がエンベロープ上のHBs抗原を構成する(⑦、⑪)。感染肝細胞は 、HBs タンパク質と脂質二重膜のみでL、M、S抗原を発現する小型の中空粒子を分泌する(⑦)。
現在、B型慢性肝炎を完治できる治療薬はありません。肝炎の進行を阻止し症状の改善を図る治療として、主に「核酸アナログ製剤」が使用されています。核酸アナログ製剤は、プレゲノムRNAからDNAへの逆転写を抑制し(図1赤矢印)、HBVの増殖を減速させて肝炎を鎮静化させます。核酸アナログ製剤の単独療法を中止するとHBVが再増殖する場合が多いため、HBVに対する免疫反応が確立されるまで投薬を継続することが推奨されています。しかし、長期投与によって薬剤耐性変異株が出現する危険性があります。
そこで、核酸アナログ製剤と異なった作用機序を示す治療薬として、「HBV表面抗原(HBsAg)特異的なモノクローナル抗体」の開発が進んでいます。しかし、B型慢性肝炎患者の血中には、感染性ウイルス粒子よりも莫大な数のHBsAg陽性の非感染性中空粒子が存在することから、ヒトに投与された中和抗体の多くが非感染性中空粒子に反応し、感染性ウイルスへの薬効が減弱することが想定されます。また、抗体を長期投与することにより、中和抵抗性に抵抗を示す変異ウイルス株の発生も懸念されます。
HBVは、ウイルス外皮タンパク質のpreS1ドメインを介してNTCPに結合し、宿主細胞に侵入することから、NTCPはウイルスの変異や中空粒子の影響に無関係な抗HBV治療薬の標的として考えられます。実際、preS1の合成ペプチドMyrcludex Bは、HBVとD型肝炎ウイルス(HDV)[10]感染を効果的に軽減し、D型慢性肝炎患者の治療薬としてヨーロッパで承認されています。しかし、Myrcludex Bの体内での半減期は短く、現在の治療のプロトコールでは毎日2 mgもの合成ペプチドの注射投与が必要なことから、より長く効果が継続する薬剤の開発が望まれています。
2.研究手法と成果
共同研究グループはNTCPを標的とし、HBV感染を選択的かつ長期に阻害するモノクローナル抗体を開発しました。NTCPの本来の機能は肝臓における胆汁酸の取り込みですが、開発した抗体はその生理活性を阻害しません。
1)免疫とハイブリドーマ[11]の作製とモノクローナル抗体の確立
NTCPは四つの細胞外ループ(ECL1~4)を伴う膜貫通型糖タンパク質で、マウスとヒトNTCP(hNTCP)は高いアミノ酸配列の類似性を持ち、相互に異なったアミノ酸残基が分子全体に広く拡散しています。hNTCPの細胞外領域を標的とするモノクローナル抗体を確立するために、抗原刺激を受けるホストとしてNTCP遺伝子を欠損するマウスを作製し、そのマウスに立体構造を維持したhNTCPタンパク質とhNTCP発現細胞株を交互に投与しました。抗原刺激後、脾臓由来の免疫グロブリンG(IgG) [12]を表面に発現するB細胞を免疫学的方法で精製し、電気融合法を用いてハイブリドーマ(融合細胞)を作製しました。
次に、得られた2万個のハイブリドーマのうち、NTCPに反応する797個を選択し、ルシフェラーゼ遺伝子組み込みHBVを利用した迅速スクリーニング法を用い、HBVの標的細胞侵入を強く抑制するモノクローナル抗体を産生する「ハイブリドーマN6HB426」を同定しました。ハイブリドーマN6HB426を限界希釈法により得たクローン上清から精製し、得られた「N6HB426-20モノクローナル抗体(N6HB426-20 mAb)」をその後の解析に用いました。
2) N6HB426-20モノクローナル抗体の中和活性とNTCPの生理活性への影響
このN6HB426-20 mAbは、in vitro(試験管内)でHBVのNTCP強発現細胞株およびヒト肝細胞へのHBV感染を強く阻止し、それぞれの感染抑制の50%阻害濃度(IC50) [13]は8~10ナノモーラー(nM、1nMは10億分の1モーラー)でした。胆汁酸の取り込みに対するIC50は1,000 nM以上であることから、N6HB426-20 mAb はHBVのヒト肝細胞への感染は阻害するが、胆汁酸の取り込みに対する阻害効果ははるかに少ない可能性が示されました(図2)。
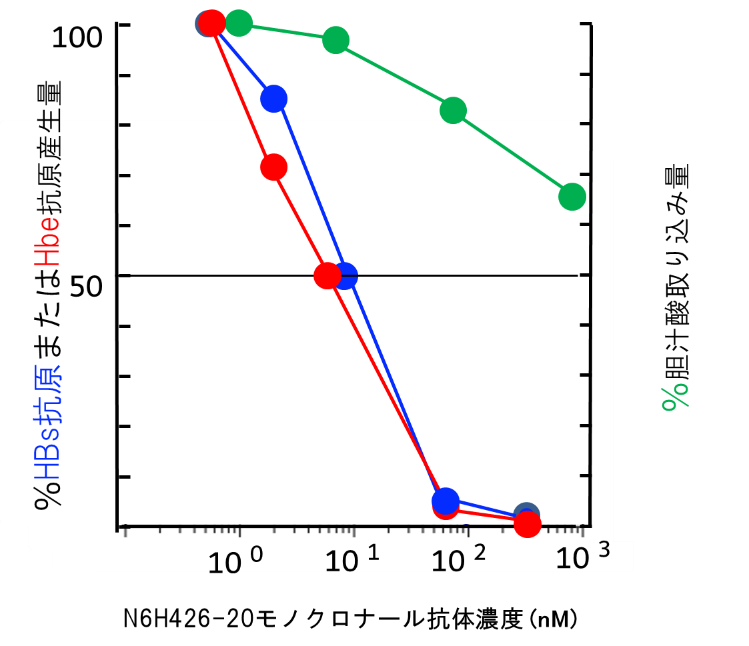
図2 試験管内でのN6HB426-20 mAbによるHBV感染抑制と胆汁酸の取り込み阻害
異なるN6HB426-20 mAb濃度において、NTCP 発現肝細胞株の胆汁酸取り込み量(緑)と同一株でのHBV感染後に産生されるHBs抗原量(青)を測定し、抗体非存在下で計測された値を100%として表示した。同様のパターンで、初代培養肝細胞感染後に産生されるHBe抗原量(赤)もN6HB426-20 mAbの濃度依存的に抑制される。
3)N6HB426-20モノクローナル抗体のHBV感染阻害の機序
HBV感染には、NTCP の細胞外ループECL1の細胞外領域アミノ酸84~87(84番目~87番目のアミノ酸残基の意味、以下同)が必要です(図3)。NTCPの細胞外領域にアラニン置換を導入した28種類のNTCPを発現した細胞株を作製し、各細胞株のHBV感染感受性とN6HB426-20 mAbの反応性を解析した結果、N6HB426-20 mAbはECL4細胞外領域アミノ酸277~278を認識することが示唆されました。NTCPの3Dモデルから、アミノ酸277~278は細胞外に突出したECL4の頂点にあり、この領域に結合したN6HB426-20 mAbは近接するECL1アミノ酸84~87へのHBVの接着を阻害する可能性が考えられました(図3)。
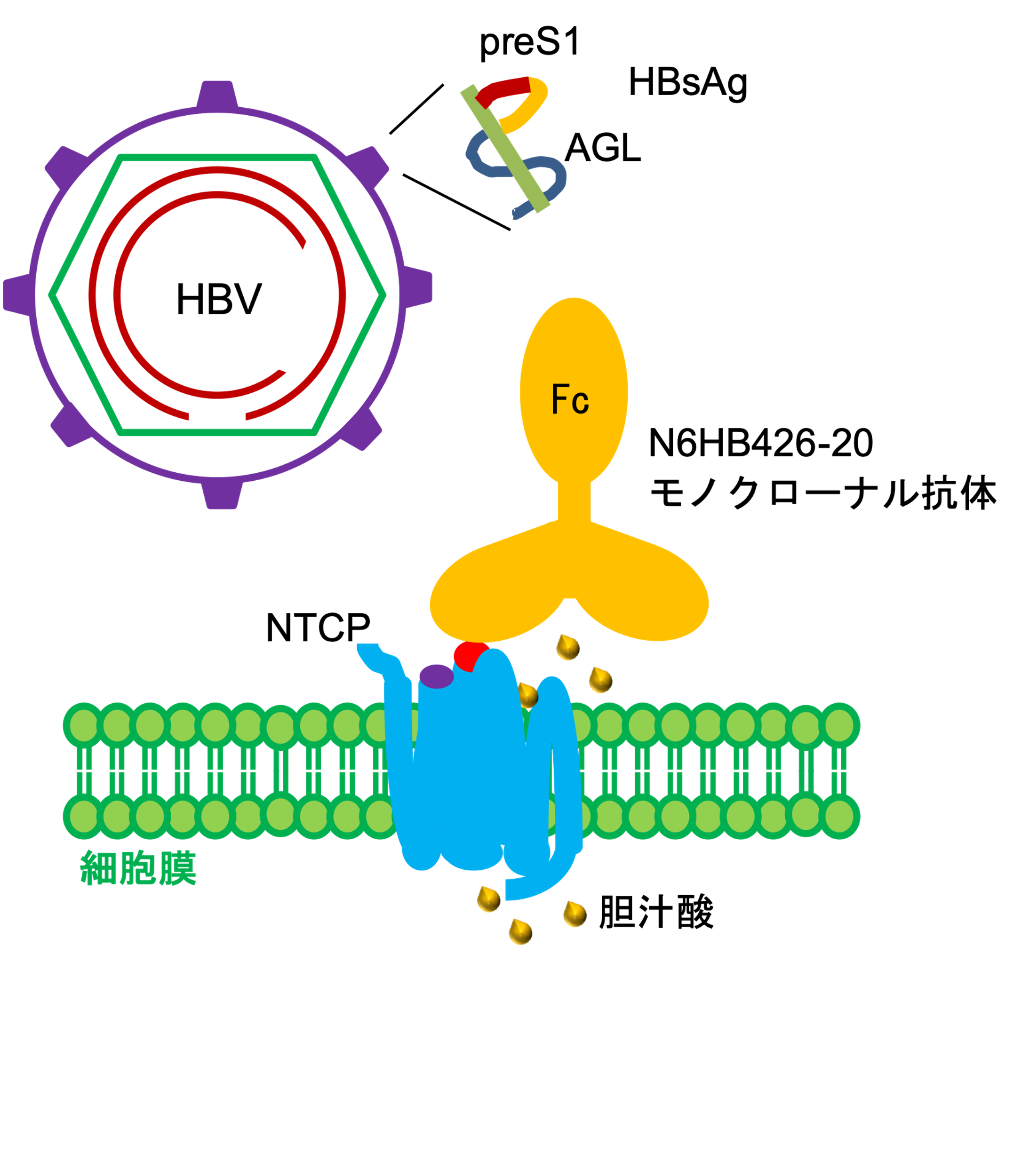
図3 N6HB426-20モノクローナル抗体によるHBVのNTCP結合の阻害
HBVはHBs抗原(HBsAg)を構築するpreS1を介してNTCPの細胞外ループECL1のアミノ酸84~87領域(紫)に強い親和性を持って接着する。N6HB426-20モノクローナル抗体(N6HB426-20 mAg) はNTCPの 細胞外ループECL4の頂点に位置するアミノ酸277~278領域(赤)へ結合し、近隣に位置するECL1アミノ酸84~87へのHBV接着を妨害すると考えられる。N6HB426-20 mAbのNTCPへの 結合は、NTCPの生理機能である胆汁酸(黄色丸)の取り込みには大きな影響を与えない。NTCPはホモ二量体の複合体を構成していると推測され、N6HB426-20 mAbは2価の結合領域で複合体に反応すると推測される。
4) N6HB426-20モノクローナル抗体のin vivoモデルマウスでの中和活性
ヒト肝臓を移植されたキメラマウス[14]に、HBV感染前後にN6HB426-20 mAbを投与したところ、ウイルスの産生を長期に抑制することが分かりました。N6HB426-20 mAb投与後、体内の胆汁酸濃度は一過性に上昇するものの、しばらくすると投与前のレベルに戻ることから、ウイルス感染阻止に必要な抗体量ではNTCPの胆汁酸取り込み活性は阻害されないことが示唆されました。
5)N6HB426-20モノクローナル抗体の特性
NTCPを介したHBV感染制御を目的として、これまでMyrcludex B以外に多くの合成ペプチドが開発されてきましたが、in vivoでの活性は不明です。また、HBV感染領域、ECL1アミノ酸56~59に対するモノクローナル抗体も開発されていますが、in vitroでの中和活性はN6HB426-20 mAbの1/10程度低く(IC50=100 nM)、またin vivoでの抗体投与による著しい活性は見られません。
モデルマウスにおいて、同様な条件でMyrcludex B 2 mg/kgの投与量と同程度の効果を得るためには、40 mg/kgのN6HB426-20 mAbの投与が必要でした。一方で、モデルマウスでのMyrcludex Bの半減期は16時間であるのに対し、N6HB426-20 mAbの半減期は最短366時間と推定され、持続効果に関してはN6HB426-20 mAbが勝ることが分かりました。
3.今後の期待
N6HB426-20 mAbは、HBV感染症のさまざまな局面で有望な治療選択肢となる可能性があります。例えば、現在緊急時の母子感染[15]予防に用いられているB型肝炎免疫グロブリン(HBIG)[16]の原料は献血による血液であることからHBV、C型肝炎ウイルス(HCV)、ヒト免疫不全ウイルス(HIV)などの感染症に対する検査を経て安全対策を講じて製造されています。しかし、原料に由来する感染症伝播などのリスクを完全には排除できません。また、国内の献血を対象とする受給体制が困難とされているため、N6HB426-20 mAbが代替薬剤となることが期待できます。
B型慢性肝炎患者に核酸アナログ製剤を投薬することでウイルスの複製を効率的に阻害しますが、慢性的に感染した細胞からは常に低レベルのHBVが産生され、非感染肝細胞への感染が拡大してしまいます。このステップはウイルス逆転写酵素/ポリメラーゼ[17]の活性には無関係に進行することから、ウイルスの侵入を阻害するN6HB426-20 mAbを併用することで、核酸アナログ製剤の治療効果が向上する可能性があります。また、核酸アナログ製剤からの離脱過程でのウイルス増殖の抑制も期待できます。
N6HB426-20 mAbの中和能を改善し、ヒトに使用できるようにするためにさらなる研究を行うことで、B型慢性肝炎患者のためのより強力で、より良い治療法を確立する道を開けると考えられます。
4.論文情報
- タイトル
Establishment of a monoclonal antibody against human NTCP that blocks HBV infection - 著者名
Toshitada Takemori, Akiko Sugimoto-Ishige, Hironori Nishitsuji, Yushi Futamura, Michishige Harada, Tomomi Kimura-Someya, Takehisa Matsumoto, Teruki Honma, Miho Takana, Masami Yaguchi, Kyoichi Isono, Haruhiko Koseki, Hiroyuki Osada, Daiki Miki, Takashi Saito, Takashi Tanaka, Takehiro Fukami, Toshio Goto, Mikako Shirouzu, Kunitada Shimotohno, Kazuaki Chayama - 雑誌
Journal of Virology - DOI
10.1128/JVI.01686-21
5.補足説明
[1] Na+/タウロコール酸共輸送ポリペプチド(NTCP)
四つの細胞外ループ(ECL1~4)を伴う膜貫通型糖タンパク質で、肝臓への胆汁酸取り込みの受容体として機能する。
[2] モノクローナル抗体
特定の抗原で刺激されたB細胞は抗体産生細胞へと分化して、抗原の多様なエピトープ(ウイルスペプチド)に反応するポリクローナル抗体を分泌する。個々の抗体産生細胞クローンが産生する単一のエピトープに特異的な抗体をモノクローナル抗体と呼ぶ。
[3] 抗体医薬
免疫反応における、抗体が抗原を認識する仕組みを利用した医薬品。抗体医薬はがん細胞などの標的のみを認識して狙い撃ちするため、薬効が高く副作用が少ないというメリットがある。
[4] 核酸アナログ製剤
ウイルスが自身の遺伝情報を複製して増殖するために必須の逆転写酵素に結合し、その働きを阻害する強力なB型肝炎治療薬。
[5] 遺伝子型
HBVはゲノム全体での8%を超える配列の相違によって、A、B、C、D、E、F、G、Hの8種類の遺伝子型に分類される。各遺伝子型HBs抗原のアミノ酸配列は一部異なり、特定の遺伝子型のHBs抗原に対する抗体が他の遺伝子型に属するHBs抗原に低反応を示すとの報告がある。日本のB型肝炎は主に遺伝子型C、Bに属するが、近年慢性化しやすいA型が増加傾向にあるといわれている。
[6] HBs抗原
HBVの外殻を構成するタンパク質で、三つのドメイン(preS1、preS2、S)から構成される。三つのドメイン全てを構築する抗原はL型抗原、Pre-S1を欠く抗原はM型抗原、Pre-S1とPre-S2を欠く抗原をS型抗原と呼ぶ。S型抗原はヘパラン硫酸プロテオグリカンと反応し、Pre-S1ドメインがNTCPを認識する。
[7] 非感染性中空粒子
感染肝細胞で作られ、細胞外へ放出されるウイルス粒子の大部分がHBs抗原を発現し、ウイルスゲノムを持たない小型の中空粒子で、その数は感染性ウイルス粒子の100~1,000倍となる(図1⑦)。この大量のサブウイルス粒子は、HBV 特異的抗体によるウイルス感染の中和を困難にするデコイ(おとり)となるが、感染性粒子のNTCPへの結合は障害しない。
[8] 胆汁酸
胆汁酸は肝臓でコレステロールより合成され、胆嚢に蓄えられて濃縮される。食物摂取後、胆嚢に蓄えられた胆汁酸は、十二指腸管内に分泌され、脂溶性の高い物質を乳化して食物中の脂肪の吸収を助ける。大部分の胆汁酸は、回腸末端の腸細胞に発現する回腸ナトリウム/胆汁酸共輸送体を介して再吸収され、門脈循環に放出され肝臓に戻る。肝臓で胆汁酸は主としてNTCPにより肝細胞に取り込まれるが、有機陰イオン輸送ポリペプチド(OATP)ファミリーのOATP1B1およびOATP1B3によっても吸収される。OATPはNTCPと異なるタンパク質ファミリーに属し、N6HB426-20 mAbが反応する可能性はない。
[9] cccDNA(covalently closed circular DNA)
B型肝炎ウイルスに特徴的なゲノムDNA。感染後の細胞核内で、前駆体DNA(rcDNA)より転換されたcccDNA は感染肝細胞の核内に6~8カ月間留まる。cccDNAは宿主由来ヒストンに結合しクロマチン構造をとり、宿主染色体と同様にヒストン修飾を介した転写制御を受ける。cccDNA は子孫ウイルスのゲノムやタンパク質を生成するために必須な鋳型で、ウイルスゲノムRNAや種々のウイルス粒子形成に必要なタンパク質をコードするmRNAを産生する。
[10] D型肝炎ウイルス(HDV)
肝臓の急性および慢性感染症を引き起こす小さなマイナス鎖RNAサテライトウイルス。HDVは、ウイルス粒子の形成とそれに続く受容体を介した肝細胞への侵入のためにHBV外皮タンパク質を必要とすることから、HBVとの同時感染または重感染として現れる。慢性HBVキャリアの約5%がHDVに重複感染していると推定されており、世界中で1,500~2,000万人の感染患者がいる。
[11] ハイブリドーマ
免疫したマウスからの活性B細胞と自身の抗体遺伝子の発現を欠損し、無限に増殖するマウス骨髄腫(ミエローマ)を、融合剤を用いて強制的に融合した細胞。ハイブリドーマは、活性B細胞が発現する抗体遺伝子から転写された抗体を分泌する能力を持ち、細胞のクローン化によりモノクローナル抗体が得られる。
[12] 免疫グロブリンG(IgG)
免疫グロブリンには、IgG、IgA、IgM、IgD、IgEの5種類があり、未刺激のB細胞はIgM抗体の膜型の単量体を表面に発現する。抗原刺激後の活性化、分化に伴い多くのB細胞はIgMからIgGにスイッチした膜型抗体を発現する活性分裂を繰り返す胚中心B細胞、記憶B細胞、抗体産生細胞が出現する。
[13] 50%阻害濃度(IC50)
試験管内において対象とする生物学的動態を50%阻害するために必要な薬物の濃度。
[14] キメラマウス
本研究では、肝細胞が80%以上ヒト肝細胞に置き換わったマウスを指す。遺伝的に肝障害を発症するウロキナーゼプラスミノーゲンアクチベータマウスとSCIDマウスを掛け合わせたホモ型マウスにヒト肝細胞を移植して作製した。
[15] 母子感染
HBV感染者でウイルス量の多い妊婦から出生した乳児を放置した場合、感染率は100%、キャリア(保有者)化率が80~90%となる。母子感染を防御するために生後12時間以内にHBIG(B型肝炎免疫グロブリン)の投与とHBワクチンの接種を行い、その後2回の追加接種をする。接種後のHBs抗体獲得例は86%との報告がある。
[16] B型肝炎免疫グロブリン(HBIG)
HBs抗体の濃度が高い免疫グロブリン製剤で、B型肝炎ウイルス陽性の血液などに接触し感染の可能性のある人に事故後すぐに投与する。また、B型肝炎保有者の妊婦から出生した乳児に母子感染予防のため、出産後すぐに投与する。赤十字が全献血者を対象に高力価の抗体を有する血漿を選別して製造し、さまざまな安全対策が講じられているが、ヒトの血液を原料としていることに由来する感染症伝播などのリスクを完全には排除できていない可能性がある。
[17] ウイルス逆転写酵素/ポリメラーゼ
逆転写酵素自身が持つRNAの塩基配列を鋳型として、相補的DNAを合成するRNA 依存性 DNAポリメラーゼ。
6.発表者・機関窓口
*今般の新型コロナウイルス感染症対策として、理化学研究所では在宅勤務を実施しておりますので、メールにてお問い合わせ願います。
発表者
※研究内容については発表者にお問い合わせください。
- 理化学研究所
生命医科学研究センター 創薬抗体基盤ユニット
ユニットリーダー(研究当時) 竹森 利忠 (たけもり としただ)
(現 炎症制御研究チーム 客員研究員)
科技ハブ産連本部 創薬・医療技術基盤プログラム
マネージャー 深見 竹広 (ふかみ たけひろ)
E-mail:toshitada.takemori[at]a.riken.jp(竹森)
機関窓口
- 理化学研究所 広報室 報道担当
E-mail:ex-press[at]riken.jp - 国立国際医療研究センター(NCGM)企画戦略局 広報企画室
TEL:03-3202-7181
E-mail:press[at]hosp.ncgm.go.jp - 広島大学 財務・総務室広報部広報グループ
TEL:082-424-3701
E-mail:koho[at]office.hiroshima-u.ac.jp
※上記の[at]は@に置き換えてください。















