トップページ > 研究部紹介 > 細胞組織再生医学研究部 > 研究のご紹介 > 肝臓の研究
細胞組織再生医学研究部 細胞療法開発研究室
東京大学大学院新領域創成科学研究科 メディカル情報生命専攻
幹細胞制御研究分野(東京大学分子細胞生物学研究所) 田中 稔
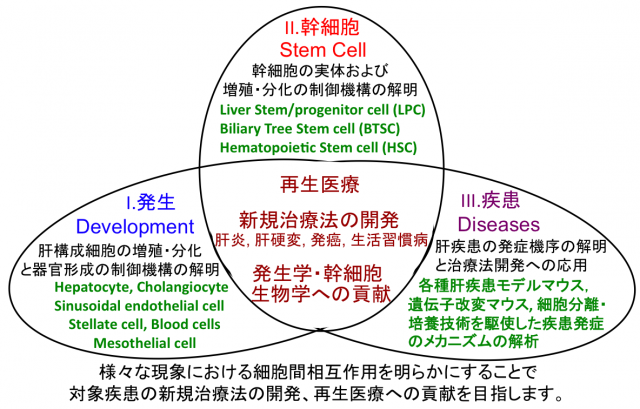
肝臓は体内最大の代謝器官であり、傷害に対して高い再生能力を備えた臓器としても知られています。肝臓は肝機能の大部分を担う肝細胞とそれ以外の非実質細胞と呼ばれる種々の細胞群から構成されています。 これらの細胞群が各々の機能を発揮しつつ、コミュニケーションを取ることで細胞社会が形成され、肝臓の恒常性は維持されています。一方、種々の要因で肝臓が傷害を受けると、各細胞が情報交換することで速やかに肝臓は再生しますが、傷害が慢性化し細胞社会が破綻すると、生活習慣病の1つである非アルコール性脂肪性肝炎や、肝硬変、肝癌といった重篤な肝疾患につながります。
当研究室では肝臓の発生、再生、疾患といった様々な局面において、肝臓内で起こっている細胞間相互作用を理解し、それらの制御メカニズムを解明することを目的としています。特に発生・再生や発癌では、幹細胞に、肝炎や線維化では、免疫細胞と肝星細胞に注目しており、これまでに確立した細胞分離技術、in vitro 培養法、遺伝子改変マウス等を利用することで、それらの実体に迫るとともに、得られた知見を再生医療や様々な肝疾患(肝炎、肝硬変、肝細胞癌、胆管癌など)の治療法開発へ臨床応用していくことを目指しています。
肝臓の基本構造
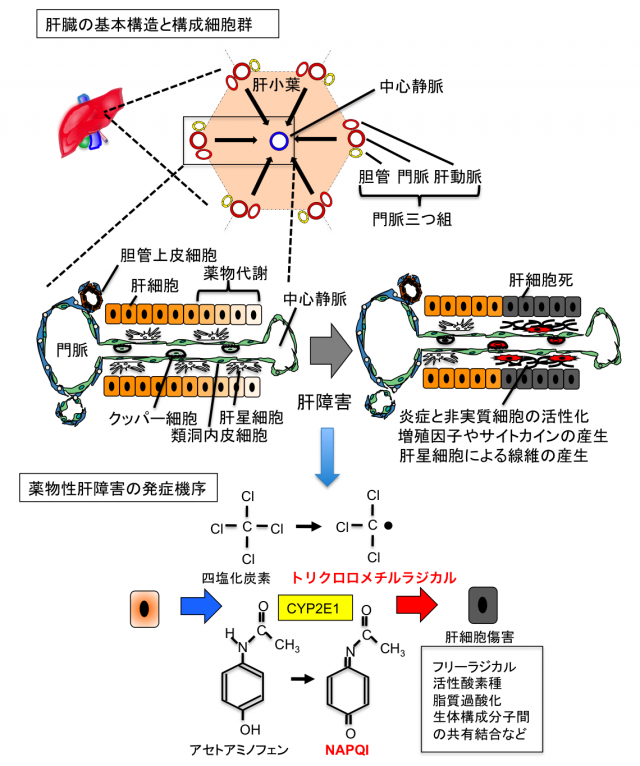
肝臓は体内最大の重量をなす実質臓器であり、「生体の化学工場」に例えられるように、各種の代謝、解毒、胆汁の産生、血清タンパク質の産生など多種多様な機能を担うことで生体の恒常性維持に寄与しています。これらの肝機能の大部分は肝実質細胞である肝細胞(Hepatocyte)によって担われています。肝臓の構造は図に示したように「肝小葉」と呼ばれる最少基本単位の集合体として表され、肝小葉は門脈,肝動脈,胆管が集まった「門脈三つ組(Portal Triad)」を頂点とする六角形または多角形からなります。肝臓には小腸で吸収された栄養に富んだ血液が門脈から、酸素に富んだ肺からの血液が肝動脈からそれぞれ流入し、肝特有の毛細血管網である類洞を経由して、肝小葉の中心に配置された中心静脈に集められ肝臓外へと出て行きます。一方、肝細胞が産生する胆汁は肝細胞間に形成された毛細胆管を通って、門脈の周囲に存在する肝内胆管へと集められ、肝外に存在する胆管を経由して最終的に十二指腸へと排出されます。
肝臓内細胞社会の主な住人達
肝臓は肝細胞以外にも多くの細胞種から構成されており、それぞれが決められた持ち場で機能し、いわば細胞社会を形成することで恒常性は維持されています。それでは肝臓内の主な住人達を紹介しましょう。
肝細胞(Hepatocyte)
前述したように肝機能の大部分を担う細胞ですが、実は一様な集団ではなく、例えば,門脈周囲の肝細胞は糖新生に関わる酵素の発現が高く、中心静脈周囲では薬物代謝に関わるチトクロムP450酵素群の発現が高いといったように、代謝機能の領域特異性(metabolic zonation)が存在することが知られています。この領域特異性を決める要因としてはWntシグナルや酸素分圧などの関与が指摘されていますが、詳細な機構については明らかになっていません。
胆管上皮細胞(Biliary epithelial cell; Cholangiocyte)
胆汁を排出するための胆管を構成する細胞です。胆管には大きく分けて、肝臓内に張り巡らされた胆管である肝内胆管と、肝臓外に存在し肝臓と十二指腸をつなぐ肝外胆管が存在します。胆管上皮細胞も形態や機能、遺伝子発現等において一様な集団ではなく、肝内末梢の肝内胆管細胞は立方上皮であるのに対し、肝外胆管細胞は円柱上皮の形態を取り、ムチン等の粘液を産生する細胞も存在します。
肝類洞内皮細胞(Hepatic Sinusoidal Endothelial Cell)
肝特有の血管網である類洞を構成する内皮細胞です。肝臓の類洞は他の臓器の血管とは異なり、基底膜を有しません。また、他の血管内皮細胞との違いとして類洞内皮細胞の細胞体には有窓構造または篩(ふるい)板構造と呼ばれる無数の穴が空いています。このような類洞の特徴が血液と肝細胞間の効率的な物質交換を可能にしています。
肝星細胞(Hepatic Stellate Cell)
肝星細胞は類洞と肝細胞の間のDisse腔と呼ばれる空間に存在する細胞で、ビタミンAを貯蔵する細胞として知られています。また、慢性肝障害時には筋線維芽細胞様に分化転換し、肝臓が硬くなる原因となるコラーゲン等の細胞外基質を持続的に産生するようになります。
クッパー細胞(Kupffer cell)とその他の免疫細胞
クッパー細胞は肝臓に常在する組織マクロファージです。マクロファージ系細胞は異物からの生体防御といった自然免疫以外にも、線維化や生活習慣病、発癌などの疾患、再生など様々な現象に関わることが明らかとなってきています。クッパー細胞は発生学的には骨髄内の血液幹細胞に由来しないとの報告もあり、骨髄由来の単球・マクロファージとの役割の違いが注目されます。肝臓内にはT細胞、B細胞、NKT細胞、NK細胞、樹状細胞などの獲得免疫や自然免疫に関わる免疫細胞も数多く存在しています。
肝障害後の再生と線維化
肝臓は再生能の高い臓器であり、マウスやラットを用いた実験では肝臓の約3分の2を外科的に切除しても、残存する肝臓が肥大や増殖することにより一週間程度で元の重量まで回復することが知られています。このような肝の再生能力と予備能力の高さが、ヒトにおいても生体肝移植を可能とする基盤となっています。一方、肝臓は多くの薬剤の解毒の場であるのみならず、腸管から細菌成分が流入するなど、生体防御の前線となる性格上、危険因子にさらされる機会は少なくありません。肝障害の要因には、ウイルス感染、薬物、免疫異常、代謝異常など様々ありますが、いずれの場合も血液中の多様な免疫細胞による炎症反応を伴った肝細胞死が肝炎の主要な病態となります。
肝再生に関わる分子メカニズムの研究は、ラットやマウスなどを用いた肝切除や薬物性肝障害などの動物モデル実験により精力的に行われてきました。肝細胞内でのチトクロムP450系による薬物の解毒は、時として毒性(反応性)の高い中間代謝物を生成させ、それらが細胞構成蛋白質,脂質,糖質,核酸などと反応すると、肝細胞自体が傷害を受け死に至ります。図に示したように、薬物性肝障害モデルとして汎用されている四塩化炭素投与では、P450酵素であるCYP2E1を主とする代謝によりフリーラジカルが発生し、肝細胞が選択的に死に至ります。同様に、風邪薬に含まれるアセトアミノフェンも大量に投与すると、反応性の高いN-アセチル-P-ベンゾキノンイミン (NAPQI:N-acetyl-p-benzoquinone imine)が肝細胞内に蓄積し、細胞障害を引き起こす要因になります。このような薬物性の急性肝炎モデルにおいては、P450酵素群の発現が高い中心静脈域で広範な肝細胞死が誘導されますが、障害が一過性であれば、肝臓の住人達が一時的に活性化して、サイトカインや増殖因子といった液性因子による細胞間コミュニケーションを行ない、肝臓は数日で元の状態に再生します。しかし、肝炎が長期化すると細胞社会が破綻し、肝線維化から肝硬変、さらに肝癌へと進行するリスクが高まります。とりわけ、非アルコール性の脂肪性肝炎(Nonalcoholic Steatohepatitis: NASH)は食の欧米化に伴う生活習慣病の一つとして近年大きな問題となっています。
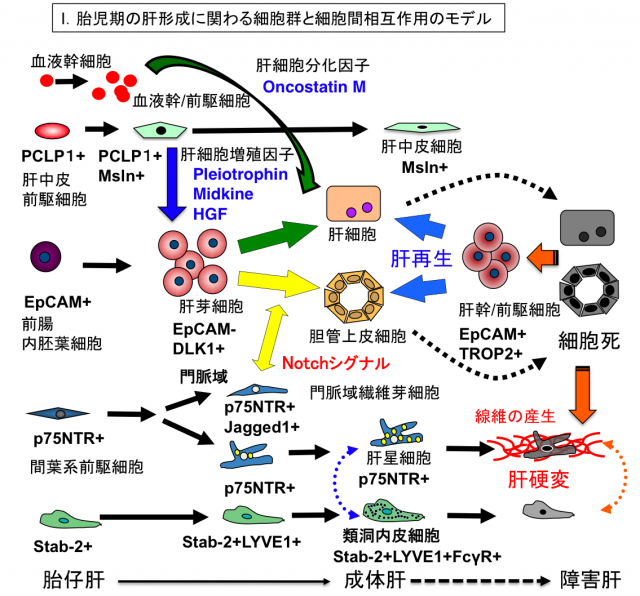
上の図は肝発生における細胞系譜と細胞表面マーカー分子の変動を示したモデル図です。肝発生は前腸内胚葉細胞からEpCAM陽性DLK1陽性の肝芽細胞が出現することから始まります。肝芽細胞は高い増殖能と肝細胞と胆管上皮細胞への二方向性分化能を有する胎児期の肝幹/前駆細胞と考えられています。胎生中期以降にはPCLP1陽性Msln陽性の中皮細胞が産生する増殖因子が肝芽細胞の増殖に寄与します。胎児期の肝臓は造血器官として機能し、血液幹/前駆細胞が盛んに増殖すると共に、血液細胞が産生するオンコスタチンMが肝芽細胞に作用して肝細胞への分化を促進します。一方、門脈域のp75NTR陽性線維芽細胞はJagged1を発現し、Notchシグナルを介して肝芽細胞の胆管上皮細胞への分化を促進します。これらの未分化な肝臓構成細胞の分離技術や、増殖・分化に関わる細胞間相互作用の知見は、iPS細胞からの肝細胞の分化誘導法に応用されています。また、重篤な肝障害時に出現する肝幹/前駆細胞は肝細胞や胆管上皮細胞へ分化することで肝再生に寄与すると考えられています。現在、細胞死を起点として発信されるシグナルが、その後の肝再生や肝線維化にどのような影響を及ぼすのかについて、細胞間相互作用という観点から研究を進めています。
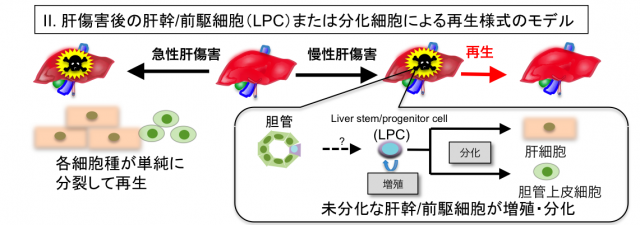
肝臓は傷害に対して高い再生能を有しますが、急性肝傷害では、残存した肝細胞が分裂することで肝臓は再生するのに対し、慢性肝傷害では持続的な肝細胞死による炎症、肝線維化を背景として、未分化性の高い肝幹/前駆細胞(Liver progenitor cell; LPC)が一過的に増殖・分化することで再生に寄与すると考えられています(図)。我々はこれまでにLPCマーカー分子としてEpCAMとTROP2を同定し、LPCの性状解析を行なってきました。現在、さらに新規のLPCマーカー分子を同定し、その機能を解析するとともに、LPCの増殖や分化の制御に関わる液性因子も同定しており、LPCによる肝再生機構について研究を進めています。また、LPCマーカー分子の肝発癌における機能解析も現在進行しています。
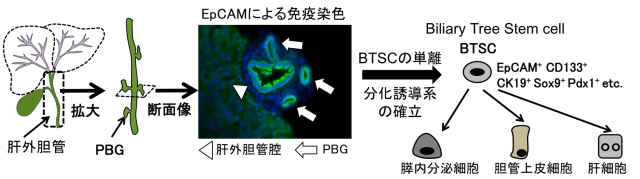
近年、肝外胆管の附属腺(Peribiliary gland; PBG)には肝内のLPCとは異なる胆道系幹細胞 (Biliary Tree Stem Cell; BTSC)が存在するという報告がなされています。我々はBTSCについても研究を進めており、その実体の解明と膵β細胞への分化誘導による再生医療への応用を目指しています。
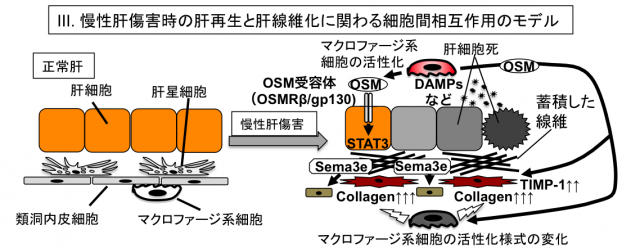
従来、死細胞は生体にとって有害であり、速やかに除去されるべき対象であると考えられてきました。ところが近年、死細胞より放出される因子が積極的に周囲に情報(ダイイングコード)を発信して影響を及ぼし、生体の恒常性維持に寄与するという新しい概念が提唱されてきています。細胞死の様式は従来のアポトーシスとネクローシスの分類にとどまらず、多様であることが分かってきており、肝疾患における細胞死の様式もまた一様ではありません。我々は肝障害後の再生や線維化に影響を及ぼしうるダイイングコードに焦点を当て、現在研究を進めています。例えば、細胞死に陥った肝細胞から放出されるSemaphorin3e (Sema3e)が類洞内皮細胞に作用することで、その後の再生や線維化に影響を及ぼすことを最近報告しました。また、死細胞から放出されるDAMPs(Damage-Associated Molecular Patterns)によって活性化したマクロファージが産生するオンコスタチンM(OSM)が肝再生や肝線維化において重要な役割を果たすことを明らかにしつつあります。これらの分子以外にも、肝線維化やLPCによる肝再生に関わる分子を探索しており、幾つかの候補分子については、現在さらに詳細な解析を進めています。















